推薦產(chǎn)品
RECOMMOND聯(lián)系我們
Contact聯(lián)系人:張經(jīng)理
手 機:18600516852
電 話:400 0000 439
地 址:北京市昌平區(qū)沙河鎮(zhèn)昌平路97號7幢605室


中藥注射劑,一直都有著很多的爭議,首先是不良反應(yīng),其次是其風險性,2006年的魚腥草注射劑事件,2011年的生脈注射液事件,2017年的紅花注射劑事件……每一次都震動整個醫(yī)藥行業(yè)。2017年,中藥注射劑的使用規(guī)定首次進入醫(yī)保目錄,在2017年的銷售規(guī)模為1021.5億元。2019年,新版醫(yī)保藥品目錄對中藥注射劑提出了更明確、更嚴格的要求,不僅將限制的品種擴大到了45個,還將部分種類直接剔除,且要求二級以上醫(yī)療機構(gòu)才能使用,同時規(guī)定只能用在重癥或特定病種上。但是中藥注射劑在臨床上具有獨特的優(yōu)勢,其綜合療效優(yōu)于西藥制劑,開發(fā)中藥注射劑既能滿足臨床的需要,也是中藥產(chǎn)業(yè)發(fā)展和中藥現(xiàn)代化的方向之一,如何有效保證中藥注射劑的質(zhì)量安全,是中藥注射劑發(fā)展的必經(jīng)之路。
注射劑系指原料藥物或與適宜的輔料制成的供注入體內(nèi)的無菌制劑。中藥注射劑是參照注射劑的標準,從中藥材(單味或復方)中提取某些活性組分、有效部位或有效成分作為原料研制而成。
中藥注射劑,其一直的爭議性與其每年上千億的市場規(guī)模,顯然是一對矛盾體,國家對于其質(zhì)量的控制要求也是在逐步提升:
● 2007年國家藥典委員會安排的127個中藥注射劑質(zhì)量標準提高工作,但僅完成了33個品種的標準提高、修訂和頒布工作,約占全部品種數(shù)的1/4。
● 2009年原國家食品藥品監(jiān)督管理總局發(fā)布了《關(guān)于做好中藥注射劑安全性再評價工作的通知》,文件提出將分期、分批對中藥注射劑的重點品種進行風險效益評價。
● 2010年7月原國家食品藥品監(jiān)督管理總局發(fā)布了中藥注射劑生產(chǎn)工藝評價、質(zhì)量控制評價和非臨床研究評價的技術(shù)原則(試行),但正式的再評價指導原則尚未發(fā)布。
● 2017年10月8日中共中央辦公廳、國務(wù)院辦公廳印發(fā)《關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》,其中第二十五條提到:“對已上市藥品注射劑進行再評價,力爭用5至10年左右時間基本完成。上市許可持有人須將批準上市時的研究情況、上市后持續(xù)研究情況等進行綜合分析,開展產(chǎn)品成分、作用機制和臨床療效研究,評估其安全性、有效性和質(zhì)量可控性”。
安全評價中有毒有害物質(zhì)的監(jiān)測,重金屬是其中非常重要的一部分,2020版《中國藥典》對于中藥注射劑中重金屬檢測的要求:
0102 注射劑
【重金屬及有害元素殘留量】除另有規(guī)定外,中藥注射劑照鉛、鎘、砷、汞、銅測定法(通則2321 )測定,按各品種項下每日最大使用量計算,鉛不得超過12μg,鎘不得超過3μg,砷不得超過6μg,汞不得超過2μg ,銅不得超過150μg。
2321鉛、鎘、砷、汞、銅測定法
一、原子吸收分光光度法
本法系采用原子吸收分光光度法測定中藥中的鉛、鎘、砷、汞、銅,所用儀器應(yīng)符合使用要求(通則0406)。
二、電感耦合等離子體質(zhì)譜法
本法系采用電感輯合等離子體質(zhì)譜儀測定中藥中的鉛、鎘、砷、汞、銅,所用儀器應(yīng)符合使用要求(通則0412)。
解析
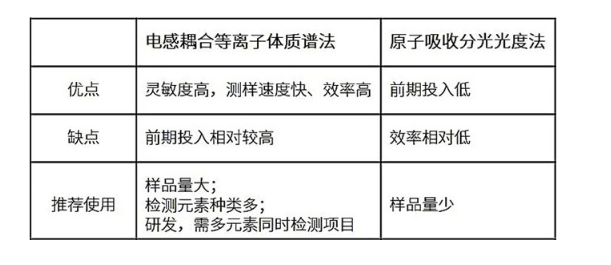
按藥典要求原子吸收分光光度法和電感耦合等離子體質(zhì)譜法都可以用來檢測中藥注射劑中的重金屬,他們各自的特點總結(jié)如下:
我們的 GC 解決方案包括使您能夠成功進行氣相色譜分析的氣相色譜分析儀、進樣器、檢測器,色譜柱、自動進樣器以及軟件。






























Copyright ? 北京京科瑞達科技有限公司 版權(quán)所有 工信部ICP備案號:京ICP備09012202號-5